跑步机训练(TT)已被用于改善帕金森病(PD)患者的步态和活动能力。TT可以诱发大脑活动来产生局部或全部的影响,让区域间连接发生有益转变。本研究通过功能性近红外光谱和功能性磁共振成像研究了TT在行走、休息期间对大脑活动和脑连接的影响。我们研究了TT6周前后的19名PD患者(74.0±6.59岁,13名男性,病程10.45±6.83年)以及对照组(19名同年龄健康被试),评估了皮层和皮层下区域间的有效连接(EC)及其与前额叶皮层(PFC)活动的相互关系。静息状态EC的支持向量回归(SVR)用于预测前额连接。分析结果表明,TT干预后,PD患者相较于对照组在行走、休息时的EC有变化。SVR揭示了与训练效果相关的PFC-小脑相关连接模式。研究表明,改变小脑区域间连接的代偿性调节可以促进训练对大脑活动的治疗效果。本文发表在npj parkinson's disease 杂志。
1.介绍
帕金森氏病(PD)是一种神经退行性疾病,临床表现为不同程度的运动迟缓、静止性震颤和肌肉强直、姿势不稳定和步态异常。步态障碍通常会随时间推移而恶化。随着不稳定性的增加,患者步态速度减慢、步长和节律性受损,严重影响了独立性和生活质量。
PD临床评估,如运动障碍疾病协会帕金森病临床诊断量表(MDS-UPDRS)或Hoehn和Yahr(H&Y)分期评估,与不同脑区间连接的改变有关。静息态功能磁共振成像(rs-fMRI)越来越多用于量化脑区间神经元网络的变化。先前研究提出了PD步态障碍的几个可能脑区,包括额叶皮层、基底神经节、小脑和脑干。然而,由于rs-fMRI测量静止状态的被试,因此只能间接反映导致步态改变的神经损伤。功能性近红外光谱(fNIRS)成像技术用来捕捉大脑的功能性血流动力学活动,可以评估实际行走过程中的皮层激活情况。对PD患者的研究表明,在正常、有规律的步行任务下,患者的背外侧前额叶皮层相较于同龄健康老人激活程度更高。以往研究表明,跑步机训练(TT)可以改善步态表现,减少简单步行任务期间的前额叶激活。一项针对PD患者的研究显示,TT干预后患者的认知功能和活动能力均有所改善,小脑活动也有所改善。然而,前额叶活动升高的神经元活动基础仍有待确定。研究显示,PD患者的皮层下区域和运动皮层子区域间的功能连通性低于健康同龄人。测量脑区间的时间依赖性可以深入了解脑区间的关系。
利用rs-fMRI和fNIRS的独特视角和优势,我们使用这两种技术进行了综合分析,以更好地了解TT对PD患者大脑活动的影响。基于先前研究,我们专注于:前额叶皮层、运动皮层、基底神经节、脑干和小脑,研究PD患者大脑连接改变的潜在模式。我们利用有效连接(EC)分析观察一个脑区对另一个脑区的有向影响,使用支持向量回归(SVR),基于静息态EC来预测行走过程中的前额叶活动。结合不同的血液动力学模式(fNIRS、rs-fMRI),研究发现了TT后前额叶活动的潜在EC预测因子,并更好地理解了与PD患者训练效果相关的皮层及皮层下脑网络相互作用(如图1)。我们假设脑区间EC是衡量训练效果的敏感指标,揭示了步行期间与前额叶活动相关的内在连接网络模式。

图1.研究路线
a)PD患者接受6周的跑步机训练。b)训练前后静息状态下的T1/fMRI采集。c)正常、双任务步行任务期间的fNIRS采集。d)使用TPDC( 时间分辨部分定向相干性)对fMRI进行EC分析。e)使用TPDC对fNIRS进行EC分析。f)以rs-fMRI连通性为预测变量的SVM分类。g)SVM回归预测fNIRS连通性。h)所有特征组合通过嵌套交叉验证。i)根据模型性能选择最优SVM模型。
2.研究方法
2.1.被试
研究招募了来自VTIME项目的19名特发性PD患者(74.0±6.6岁,13名男性,6名女性;病程10.5±6.8年),19名同龄健康对照(69.9±5.9岁,9名男性,10女性),PD患者能独立行走至少5分钟,在过去一个月内有服用稳定药物以及抗帕金森病药物。研究筛除有诊断出精神病合并症、痴呆症、其他认知障碍、任何可能影响其步态或身体状况不稳定的骨科问题的被试。研究得到TLVMC机构审查委员会的批准,所有被试在参与前都签署书面知情同意书。
2.2.临床与认知评估
在研究开始时(基线)进行临床和认知评估,评估在服药约1小时后进行。PD的临床运动障碍使用UPDRS-III和UPDRS-总分评估,认知评估包含蒙特利尔认知评估(MoCA)、步态测试(TMT),用以评估运动和执行功能。
2.3.步态和平衡评估
在研究开始时(基线)和训练完成后(跟进),使用嵌入压力传感器的Zeno人行道地毯(ProtoKinetics LLC产)测量步态。要求被试在两种情况下沿30米的人行道步行1分钟:正常步行(NW)、双任务步行(DT),DT按顺序计算三位数减法。研究对两个条件下的步幅长度、步幅平均时间和节奏进行评估。
2.4.培训协议
所有PD患者都接受了为期6周的跑步机训练。所有被试每周进行3次训练,每次训练约45分钟,以5分钟的“热身”(仅在跑步机上行走)开始。被试带着安全带在跑步机上行走,安全带可防止跌倒但不提供体重支撑。健康对照组接受相同的评估方案,但未进行任何训练。
2.5.fNIRS采集
使用PortaLite fNIRS系统(Artinis近红外脑功能成像系统介绍)评估前额皮层中的含氧血红蛋白(HbO)和血红蛋白(HHb)浓度变化,fNIRS系统配备3个红外光发射器、1个接收器,设备使用无线技术,允许被试不受电线限制自由移动。光极放置在被试的左右前额,用黑色织物遮挡环境光,大致针对左右Brodmann10区,采样率10Hz,Oxysoft软件版本为3.0.52。我们评估了跑步机训练计划前后NW(正常步行)和DT(双任务步行)任务期间的前额叶活动,每个任务5次,每次以20秒的沉默开始,被试不说话、不移动头部。20秒后,给出指令“开始”/“从数字开始”(用于DT的减法计算任务)。沿30米的人行道来回走30秒后,要求被试停下静立20秒,被试根据自身需要在实验期间休息。研究要求被试在每次测试开始前站立至少一分钟,以尽量减少站立后的血压波动。所有任务都在服药约一小时后进行。
2.6.MRI采集
被试全脑成像数据通过8通道相控阵头部线圈的3TSignaExciteMRI扫描仪采集,在6周TT前后测量患者数据,对照组仅在基线时接受MRI扫描,三维破坏梯度回波序列参数见原文。
2.7.fNIRS预处理
(1)从Artinis软件(Oxysoftv3.0.52)中提取原始光强数据;(2)转换为增量光密度(OD);(3)将移动标准偏差和样条插值方法应用于时间序列,然后使用Molavi和Dumont推荐的参数去除运动伪迹;(4)使用Beer-Lambert定律计算HbO和HHb的浓度变化。所有fNIRS预处理均在MATLAB中使用Homer2工具包完成,分析脑连接前没有过滤数据。
2.8.MRI预处理
rs-fMRI根据SPM12软件的推荐指南进行预处理:(1)移除前五个volume以解决T1弛豫效应;(2)使用刚体平移和旋转进行头部运动校正;(3)切片时间校正;(4)联合配准到解剖T1图像;(5)使用CAT12工具包将图像配准至标准MNI空间;(6)使用6mm全宽半最大值(FWHM)内核进行平滑处理;(7)去除噪声协变量(包括六个运动校正参数,以及平均WM和CSF信号)。
2.9.rs-fMRI兴趣区
基于PD运动、非运动症状相关的大规模脑网络变化选择五个ROI:前额叶皮层、运动皮层、小脑、脑干、皮层下区域(包括尾状核、壳核、苍白球内部和外核、黑质、丘脑和底丘脑核)。脑地图和分区的详细信息见表S1。每个脑区的体素根据rs-fMRI体积进行平均,并提取为时间序列。
表s1.兴趣区与隶属关系


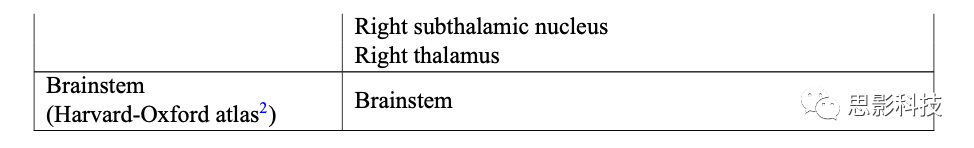
2.10.时间分辨部分定向相干
时间分辨部分定向相干性(TPDC)。采用双扩展卡尔曼滤波器估计时间序列的自回归系数,随后使用估计的时间相关多元自回归(MVAR)系数的傅里叶变换计算部分定向相干性(PDC)。时间点从时间序列xj到xi的PDC计算公式为:
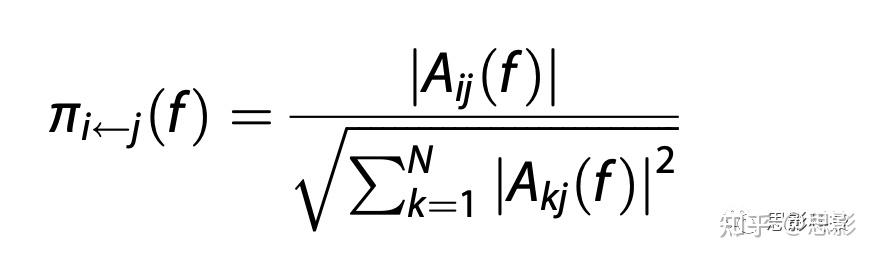
基于格兰杰因果关系原理,PDC在频域表示连接强度,其中Aij表示傅立叶变换后的MVAR系数,N表示成对连接的数量。对PDC值平方后,归一化值介于0和1之间。在rs-fMRI时间序列中,我们提取了0.009到0.08Hz的感兴趣频带,并对每个时间点取平均值,以获得脑区间的稳健连接值。我们将TPDC应用于左、右探头的fNIRS数据集,由于所有组的激活不存在左右差异,对前额叶皮层中的双向EC取平均值。步行任务的每个试次都单独计算,然后进行平均,fNIRS的提取频率范围为0.009至0.08Hz。
2.11.支持向量机
支持向量机(SVM)模型使用rs-fMRI的EC特征预测步行期间fNIRS时间序列的前额叶连接。我们使用高斯核,也称径向基函数(RBF):
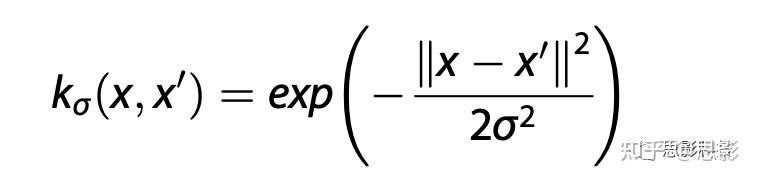
正确选择核系数和正则化参数对SVM分类表现至关重要,但找最佳超参数超出了当前研究的范围,本研究的SVM模型通过MATLAB中的统计和机器学习工具包执行,使用默认核系数和正则化参数。
2.12.特征选择和模型验证
我们使用穷举特征选择器(EFS),每个特征子集都使用SVM进行训练。在这项研究中,SVM模型对患者在基线和随访时的静息态EC(五个ROI间的20个EC)进行训练,特征组合总数为2^20=1.048576*106个。每个模型都使用嵌套交叉验证进行验证,外、内部循环使用k=5的嵌套交叉验证,模型评估使用回归模型的R平方以及模型的分类准确性、灵敏度和特异性,最佳模型根据最佳平均性能选择。
2.13.特征贡献
特征贡献评估使用Kernel SHapley Additive exPlanations(SHAP),Shapley值可以解释特征对模型预测的贡献,在研究中用于确定预测步行期间前额叶活动EC特征的贡献。全局解释由个体观察中每个特征的平均绝对Shapley值表示,Shapley绝对值大的特征视为重要特征。交叉验证中,对每个折叠的平均绝对Shapley值进行平均,Shapley值通过MATLAB中的统计和机器学习工具包计算。
2.14.统计分析
若无另外说明,所有统计分析都使用自定义编写的R脚本执行,图表使用ggplot2包生成。配对样本t检验测量TT前后行为测量的变化,非参数双向ANOVA应用于分析行走期间的平均前额叶连通性,比较:1.被试间(基线患者vs对照组,基线患者vs随访患者),2.被试内(正常步行vs双重任务步行)。统计显著性水平设置为p<0.05(双尾,FDR校正)。单样本Wilcoxon符号秩检验用于评估患者组在基线、随访时的静息态EC变化,曼-惠特尼U检验评估对照组和患者的静息态EC的差异。
2.15.相关分析
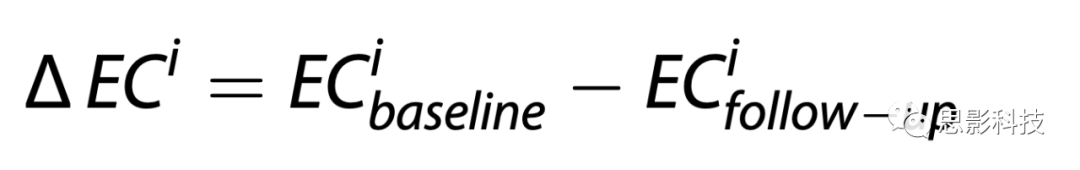
为检查患者组在基线、随访时静息态EC的关系,研究对具有统计学意义的静息态EC进行相关分析,正态性通过Shapiro-Wilk检验评估。我们使用以下公式计算患者基线和随访间EC变化的Spearman相关系数:
为进一步探索内在大脑连通性和PD特异性疾病严重程度的关联,我们计算了基线时患者UPDRS评分与静息态EC的相关系数。非正态分布的EC进行幂变换,相关分析使用Pearson相关,多重比较使用FDR校正。
3.结果
3.1.患者特征
如表1,组间未观察到年龄差异。与健康老年人相比,PD患者的蒙特利尔认知评估(MoCA)得分较低,TMT测试的完成时间较长,步态速度和步幅较低。
表1.被试情况

3.2.跑步机训练对临床评估和步态表现的影响
如表2,TT训练后,PD患者的认知和步态表现更好,TMTa和TMTb等认知评估完成时间缩短,正常步行(NW)和双任务步行(DT)的步态速度增加。TT后患者在DT步行任务中的步幅、步幅时间更长,步频更低。
表2.TT前后PD组的步态和认知表现评分

3.3.跑步机训练后行走时前额叶活动降低
图2显示了控制组以及患者在基线、随访时的两个步行任务的前额叶连接。基线时,患者和对照组间的主效应显著,但NW(正常步行)和DT(双任务步行)未发现显著差异与相互作用。患者的基线、随访表现存在显著差异,随访时,NW期间患者前额叶连通性显著低于DT。

图2.步行任务期间前额叶皮层的有效连接
3.4.训练对静息态大脑活动的影响
如图3,我们对患者基线时和对照组的每个EC进行了曼-惠特尼U检验,结果显示小脑⇀皮层下区域、运动皮层⇀皮层下区域的连接水平显著较低(基线患者<对照组)。TT训练后,患者的这些连接水平增加,患者随访时和对照组没有显著差异(详见表S2)。随访患者的脑干⇀运动皮层、皮层下区域⇀运动皮层连接水平显著低于基线,其他EC未发现统计学显著性。
EC变化的相关性如图4,两个皮层下ΔEC(小脑⇀皮层下区域,运动皮层⇀皮层下区域)呈正相关,他们的连通性变化低于对照组,两个运动相关ΔEC(脑干⇀运动皮层,皮层下区域⇀运动皮层)呈正相关,连通性变化更高。
表S2.静息态有效连通性和组间比较

图3.训练对帕金森病患者静息态有效连接的影响(BS-脑干、CB-小脑、MC-运动皮层、SC皮层下区域)
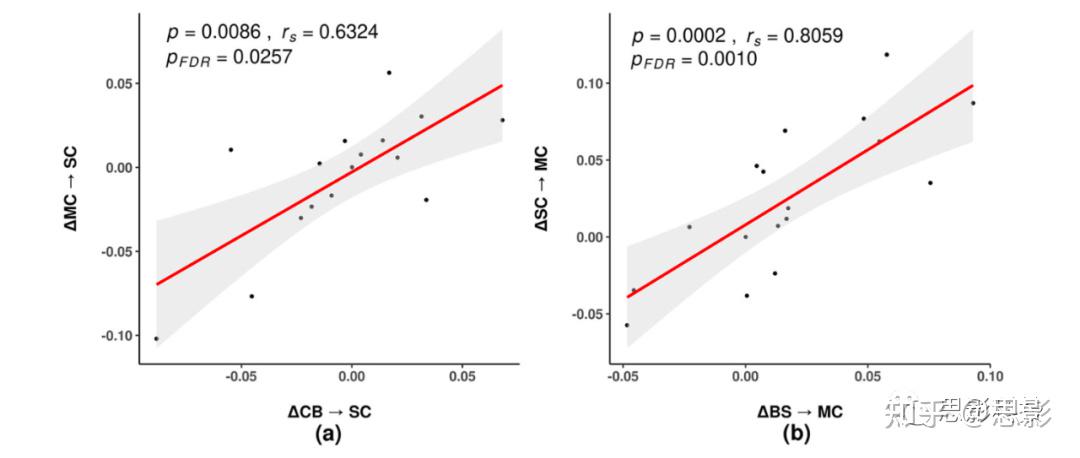
图4.PD患者ΔEC的相关性
3.5.内在大脑连接与运动表现的关联
基线时患者组的静息态大脑连通性和临床参数(UPDRS-III、UPDRS-总分)的相关性如图5,UPDRS-III与前额叶皮层⇀运动皮层连接呈负相关,表明更好的运动性能关联更高的前额叶皮层-运动皮层连接(图5a),而UPDRS总分和脑干⇀皮层下区域连通性呈正相关(图5b)。没有发现UPDRS与其他EC的统计显著性,详细结果见表S3。

图5.PD患者静息态EC和UPDRS评分的相关性
表s3.UPDRS与静息态有效连接的相关分析

3.6.步行期间前额叶活动的静息态EC
我们进一步研究了哪些静息态EC与前额叶皮层变化相关,比较了患者TT前后静息态EC训练的最佳SVR模型。图6显示了性能优于其他特征组合的基线和随访模型,R方的预测精度相似,基线患者的最佳模型使用6个EC特征进行训练,随访模型使用8个。随访时,患者表现出与基线相似的EC模式,皮层下区域⇀脑干(图6a)切换到皮层下区域⇀前额叶皮层、脑干⇀前额叶皮层和小脑⇀脑干(图6b)。根据特征贡献,小脑相关脑连接仍与前额叶活动密切相关,但基线时贡献很大的小脑⇀前额叶皮层在随访中提供信息较少。

图6.患者TT前后的最佳SVR模型
3.7.有效连接区分帕金森病患者与对照组
最佳的支持向量机(SVM)模型能区分帕金森病患者和对照组,平均准确度91.05%±2,平均灵敏度93.68%±3.9,平均特异性88.42%±7。图7展示了最佳模型和EC特征,及EC对模型预测的贡献(Shapley值)。分类器对8个EC(运动皮层⇀前额叶皮层、运动皮层⇀脑干、皮层下区⇀运动皮层、皮层下区⇀前额叶皮层、皮层下区⇀小脑、前额叶皮层⇀小脑、脑干⇀运动皮层、小脑⇀前额叶皮层)进行训练。皮层下区域⇀运动皮层的EC分类贡献最大,第二(运动皮层⇀前额叶皮层)到第六(皮层下区域⇀小脑)具有相似的尺度范围并且在分类中提供更多信息,其中运动皮层⇀前额叶皮层预测对照组的贡献大于患者组。脑干⇀运动皮层和小脑⇀前额叶皮层在所有特征中贡献最少。

图7.最佳SVM与对应的Shapley值
4.讨论
本研究是一项开创性的研究,结合了fNIRS和fMRI的方法研究PD患者在行走期间的前额叶活动EC。我们研究了PD患者的EC变化,并与年龄匹配健康对照组进行比较。我们发现TT后PD患者行走期间前额叶皮层的EC减少,静息态下脑干⇀运动皮层、皮层下区域⇀运动皮层的有向EC也降低,这些变化显示,干预后PD患者的神经变化模式趋向对照组。此外,小脑及其与脑干、皮层下区域的内在联系是预测患者组行走期间前额叶皮层EC的主要特征。TT后,主要特征增加了前额叶和脑干的定向连接(脑干⇀前额叶皮层和皮层下区⇀前额叶皮层,小脑⇀脑干和皮层下区⇀脑干),反映了TT训练后前额叶活动的减少。基于这些结果,我们通过机器学习测试了大规模脑区EC估计的灵敏度,获得了91.05%的平均准确度。
在PD患者中,黑质致密部神经元变性,纹状体的多巴胺能输入减少,因此难以产生对苍白球的短暂抑制。这增加了苍白球内部段到丘脑的强直抑制,导致运动皮层的丘脑更少被激活。这种皮层-基底神经节回路损伤意味着神经活动需要补偿,近期研究发现PD患者行走期间前额叶活动增加。地面行走涉及执行和认知功能,一项研究表明,前额叶活动增加与较差的认知表现有关。本研究中,随访时患者组NW的前额叶皮层连接显著低于DT,更接近对照组的模式。即TT训练在一定程度上减少了前额叶活动,更复杂的任务(如DT)中的认知处理需要更多的认知资源。可以推测,NW期间减少的前额叶活动可能为更复杂的并发任务留下更多认知资源,提高了效率。我们通过连通性分析发现了行走期间双侧前额叶活动的神经耦合,为该领域提供了一个新的维度。
近期研究表明,小脑在PD中起代偿作用,且与运动、认知表现相关。我们发现,TT后运动和认知通路(小脑⇀皮层下区域和运动皮层⇀皮层下区域)的EC增强(如图3)。皮层下区⇀运动皮层、脑干⇀运动皮层EC的减少,运动皮层⇀皮层下区EC的增加表明,其他脑区所需的调节作用较小,信息更多从运动皮层流向皮层下区域。
尽管FDR校正后没有统计学意义,但MDS-UPDRS-III评分和前额叶皮层⇀运动皮层连通性间发现了负相关趋势(如图5a),这表明更多的前额叶皮层⇀运动皮层信息流动与更好的PD患者运动表现相关。前额叶皮层在执行功能中起关键作用,包括规划、工作记忆和认知灵活性等认知功能管理,研究已发现了各种PD患者步态障碍的补偿策略,包括外部提示、运动想象,尽管针对运动障碍的补偿策略可能因患者而异,但我们的结果表明,前额叶皮层向运动皮层的大范围脑区内在连接可能存在补偿性调制(如图5a)。
研究还发现了脑干⇀皮层下区域连通性和UPDRS-总分间的正相关趋势(如图5b)。最近一项研究显示,神经调节脑干系统可能通过各种途径直接或间接地改变皮层群体活动。多巴胺是脑干到皮层下区域的主要神经调节剂之一,在PD患者中,中脑黑质中的多巴胺缺失不仅可能导致神经调节系统异常,还可能导致基底神经节-脑干通路功能障碍,改变皮层活动。相应的,研究发现脑干到皮层下区域的有向连接与反映认知、运动、自主功能的UPDRS总分相关。由于PD患者脑干⇀皮层下区域的连接水平低于健康对照(见表S2),与UPDRS总分的正相关可能意味着PD患者基底神经节-脑干通路的神经调节机制不同。此外,与对照组相比,PD患者在基线时的脑干⇀运动皮层连通性也显著提高,静息态的脑干EC升高可能显示了源自脑干的广泛调节作用,这也可能是运动表现受损的原因。
关于SVM模型分类,几个EC特征在基线、随访的步行任务中都有贡献。我们发现患者组的特定EC模式可以很大程度解释NW期间的前额叶皮层连接。基线时,皮层下和小脑在网络中起主要作用,连接的区域负责运动、认知功能。由于小脑到前额叶皮层的EC是信息量最大的特征,因此小脑也可能影响运动和运动学习的可变性,使前额叶皮层调节运动、步行时的认知规划或计算。随访时,数据驱动方法显示了与基线模式相似的最佳SVR模型EC特征,但具有两个额外特征,分类准确性更高。附加特征增加了特征空间的维数,在预测方面提供了更多信息,这表明更多的区域或网络参与了运动表现,特别是前额叶皮层相关EC。
EC可以以91.05%的平均准确度区分患者和对照组(见图7),每个EC特征都包含有助于分离两个被试组的信息。EC的主要特征与大脑皮层、皮层下区域相关,与皮层-基底神经节通路一致。脑干⇄运动皮层和小脑⇄前额叶皮层的相互有向连接也可能表明PD患者这些脑区的通路双向损伤。
运动皮层⇀脑干的运动通路通常通过皮层脊髓通路传播,近期研究表明PD患者的皮层脊髓束受损。根据运动皮层⇀脑干的Shapley值(如图7),该连接在区分患者、健康组方面的作用更大,反映了PD患者的连接改变。同样,小脑⇄前额叶皮层连接也是预测特征,意味着PD的双向连接可能发生病理改变。由于帕金森病中的额-小脑关联仍不明确,本研究的结果提供了一个新的视角来了解其在PD患者运动训练后代偿过程的潜在作用。
研究的局限性:1.受试者数量相对较少,但所有受试者的研究设计和血液动力学测量(fNIRS和fMRI)都提供了TT后功能变化的综合评估。2.EC估计和机器学习回归方法可能无法以线性方式相互映射,我们通过大规模脑区和基于嵌套交叉验证的机器学习模型评估,增强了结果的稳健性和普遍性。3.较低的Shapley值无法提供有关特征的冗余信息,由于它仅考虑给定模型对模型预测的分布式贡献,因此最小贡献也可能对预测至关重要。
总之,本研究证明了TT后PD患者不同脑网络的神经改变。当患者在跑步机上行走时,跑步机带可以作为外部提示来调整步态,前额叶皮层认知处理任务相关的工作量减少。研究结果还表明,TT训练可能导致其他脑区到运动皮层的补偿效应聚集。步行的静息态连接方面,小脑及其与脑干和皮层下区域的内在连接与步行期间前额叶活动有较强关联。此外,前额叶定向连接(来自脑干和皮层下区域)可能反映了跑步机训练后的大脑重组。